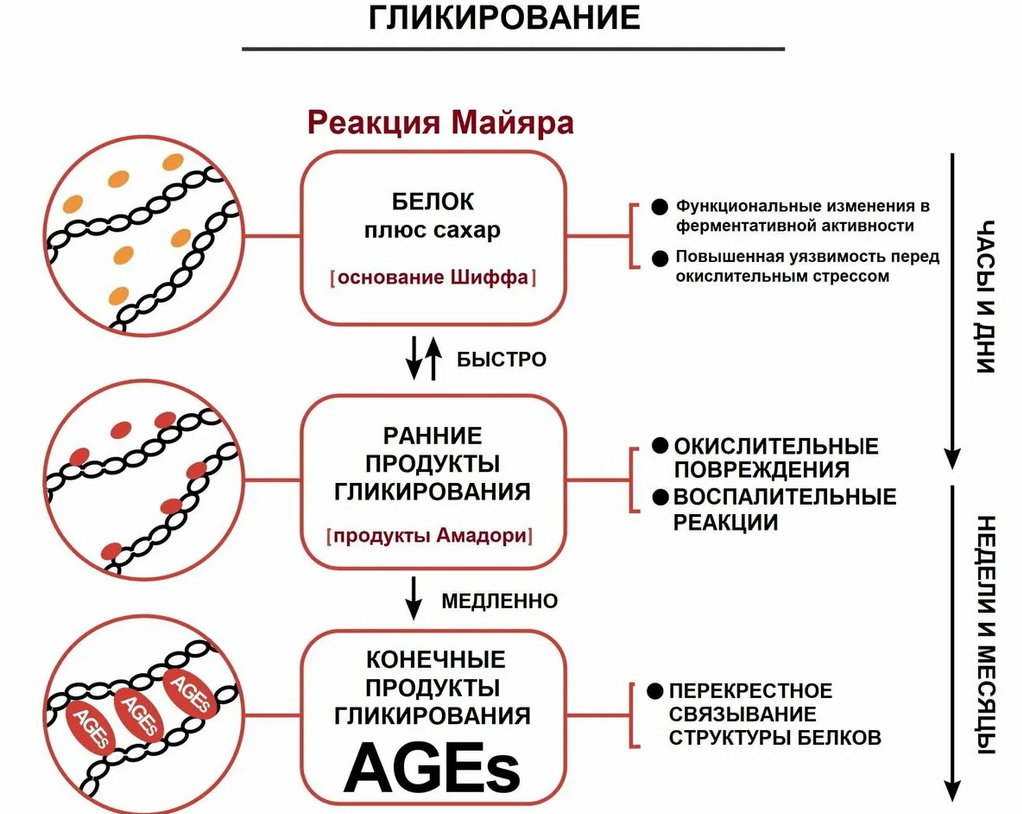
Несмотря на многочисленные работы по оценке способности различных молекул разрушать Конечные Продукты Гликирования (КПГ – AGEs — Advanced Glycation Endproducts), ни одна из них, насколько нам известно, не оценивала способность к разрушению патологических сшивок внутри и между молекулами белка. Цель этой работы состояла в том, чтобы четко показать вызванную рибозой полимеризацию альбумина, а затем способность полифенольной кислоты, экстрагированной из розмарина (Rosmarinus officinalis), и розмариновой кислоты, разрушать предварительно сформированные полимеры альбумина.
Методы. Альбумин гликировали инкубацией с рибозой, а полученные полимеры белка оценивалиметодом гель-размерной эксклюзионной хроматографии (ГРХ) и флуориметрии. После элиминации рибозы методом диализа белки обрабатывали розмариновой кислотой, аминогуанидином, карнозином и Алагебриумом (ALT-711; Alteon) в качестве положительного контроля. Степень дегликирования определяли по соотношению количеств полимеризованного и нативного альбумина — до и после обработки дегликирующими молекулами.
Результаты. Было показано, что розмариновая кислота разрушает образовавшиеся поперечные сшивки так же эффективно, как и Алагебриум. В противоположность этому, аминогуанидин и карнозин, ингибиторы реакции гликирования, не продемонстрировали значимого обращения вспятьпроизошедшей полимеризации альбумина.
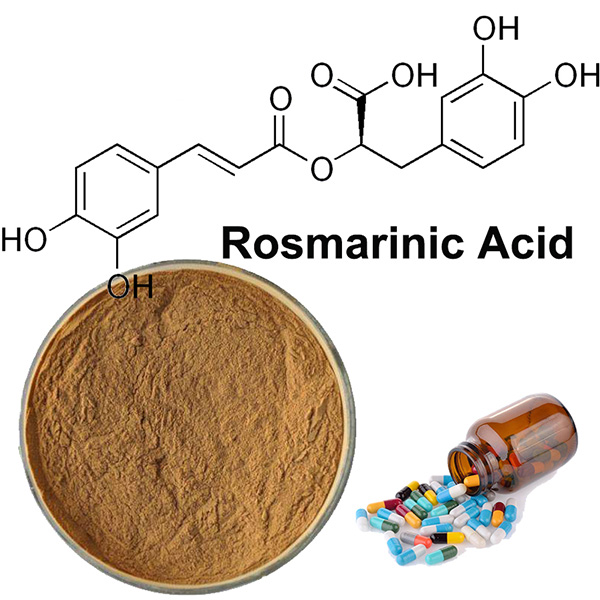
Розмариновая кислота — это природное соединение, относящееся к классу полифенолов. Она широко распространена в растениях и известна своими мощными антиоксидантными, противовоспалительными, антимикробными и другими биологически активными свойствами. Розмариновая кислота была впервые выделена из растения розмарин (Rosmarinus officinalis), от которого и получила свое название, но также содержится во многих других растениях, таких как мелисса, шалфей, мята, базилик и тимьян.
Химическая структура
Розмариновая кислота — это сложный эфир, образованный из двух фенольных соединений: кофейной кислоты и 3,4-дигидроксифенилмолочной кислоты. Ее химическая формула — C₁₈H₁₆O₈. Структура включает:
- Два ароматических кольца (фенольные группы).
- Гидроксильные группы (-OH), которые обеспечивают антиоксидантные свойства.
- Карбоксильную группу (-COOH), которая придает соединению кислотные свойства.
Источники розмариновой кислоты
Розмариновая кислота содержится во многих растениях, особенно в семействе губоцветных (Lamiaceae). Основные источники:
Содержание розмариновой кислоты (ориентировочное):
-
Розмарин (Rosmarinus officinalis): 0.5 — 2.5% (5 — 25 мг/г). Розмарин — один из наиболее богатых источников, наряду с шалфеем и мелиссой. Основные кислоты здесь — карнозная и розмариновая.
-
Мелисса (Melissa officinalis): 1.5 — 4.0% (15 — 40 мг/г). Один из абсолютных лидеров по содержанию розмариновой кислоты, которая является ее ключевым биологически активным компонентом.
-
Шалфей (Salvia officinalis): 1.0 — 3.5% (10 — 35 мг/г). Также очень богат розмариновой кислотой, особенно некоторые виды шалфея (например, Salvia miltiorrhiza).
-
Мята (Mentha spp.): 0.2 — 2.0% (2 — 20 мг/г). Содержание сильно зависит от вида. Например, перечная мята (Mentha × piperita) обычно содержит 1-3%.
-
Базилик (Ocimum basilicum): 0.1 — 1.5% (1 — 15 мг/г). Особенно высокое содержание отмечается в фиолетовых сортах и священном базилике (туласи).
-
Тимьян (Thymus vulgaris): 0.1 — 0.8% (1 — 8 мг/г). Не является основным источником, присутствует в умеренных количествах наряду с тимолом и карвакролом.
-
Орегано (Origanum vulgare): 0.4 — 2.0% (4 — 20 мг/г). Содержание может быть довольно высоким, но сильно колеблется в зависимости от хемотипа (фенольный тип орегано содержит больше розмариновой кислоты).
Биологическая активность и польза для здоровья
Розмариновая кислота обладает широким спектром биологических свойств, которые делают ее ценным соединением для медицины, косметологии и пищевой промышленности.
1. Антиоксидантная активность
Розмариновая кислота является мощным антиоксидантом, способным нейтрализовать свободные радикалы и предотвращать окислительный стресс. Это достигается за счет:
- Подавления образования активных форм кислорода (АФК).
- Увеличения активности антиоксидантных ферментов, таких как супероксиддисмутаза (SOD) и глутатионпероксидаза (GPx).
- Хелатирования ионов металлов, которые могут катализировать окислительные реакции.
2. Противовоспалительное действие
Розмариновая кислота подавляет воспалительные процессы путем:
- Ингибирования ферментов циклооксигеназы (COX) и липоксигеназы (LOX), которые участвуют в синтезе провоспалительных медиаторов (простагландинов и лейкотриенов).
- Снижения уровня провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6.
- Подавления активации NF-κB — ключевого фактора транскрипции, регулирующего воспалительные реакции.
3. Антимикробная активность
Розмариновая кислота проявляет антибактериальные, противовирусные и противогрибковые свойства. Она:
- Нарушает целостность клеточных мембран микроорганизмов.
- Подавляет рост бактерий, таких как Staphylococcus aureus и Escherichia coli.
- Ингибирует репликацию вирусов, включая вирус герпеса.
4. Нейропротекторное действие
Розмариновая кислота защищает нейроны от повреждений, вызванных окислительным стрессом и воспалением. Она:
- Уменьшает нейровоспаление.
- Предотвращает гибель нейронов при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и Паркинсона.
- Улучшает когнитивные функции и память.
5. Антидиабетическое действие
Розмариновая кислота помогает контролировать уровень сахара в крови за счет:
- Увеличения чувствительности клеток к инсулину.
- Ингибирования ферментов, участвующих в расщеплении углеводов (например, α-глюкозидазы).
6. Кардиопротекторное действие
Розмариновая кислота защищает сердечно-сосудистую систему путем:
- Снижения уровня холестерина и триглицеридов в крови.
- Улучшения функции эндотелия сосудов.
- Предотвращения окисления липопротеинов низкой плотности (ЛПНП), что снижает риск атеросклероза.
7. Противовоспалительное действие на кожу
Розмариновая кислота используется в косметологии для:
- Уменьшения воспаления и покраснения кожи.
- Защиты от ультрафиолетового излучения.
- Ускорения заживления ран.
Защита от фиброза:
- Исследования показывают, что розмариновая кислота может замедлять развитие фиброза печени, подавляя активацию звездчатых клеток, которые играют ключевую роль в образовании рубцовой ткани.
Применение розмариновой кислоты
- Медицина:
- Используется в качестве добавки для лечения воспалительных заболеваний, диабета и нейродегенеративных расстройств.
- Входит в состав препаратов для улучшения иммунитета и защиты от инфекций.
- Косметология:
- Добавляется в кремы, сыворотки и лосьоны для защиты кожи от старения и повреждений.
- Используется в средствах для лечения акне и других воспалительных заболеваний кожи.
- Пищевая промышленность:
- Применяется как натуральный консервант благодаря антимикробным свойствам.
- Добавляется в функциональные продукты питания для повышения их антиоксидантной активности.
Безопасность и побочные эффекты
Розмариновая кислота считается безопасным соединением при употреблении в умеренных количествах. Однако в высоких дозах она может вызывать:
- Аллергические реакции у чувствительных людей.
- Расстройства желудочно-кишечного тракта (например, тошноту или диарею).
Заключение
Розмариновая кислота — это многофункциональное соединение с широким спектром биологической активности. Ее антиоксидантные, противовоспалительные, антимикробные и нейропротекторные свойства делают ее ценным компонентом для медицины, косметологии и пищевой промышленности. Исследования продолжают раскрывать новые возможности применения этого уникального полифенола для улучшения здоровья и качества жизни.